- Révolution énergétique
- Principe de fonctionnement
- Composition de l’électrolyte
- Électrolyte «Water-in-Salt» (WiSE)

Révolution énergétique
En 2019, John B. Goodenough, M. Stanley Whittingham, et Akira Yoshino reçurent le prix Nobel de chimie pour le développement des batteries lithium-ion. Depuis leur commercialisation par Sony en 1991, ces batteries légères, rechargeables, et efficaces ont en effet bénéficié aux smartphones, ordinateurs portables ou véhicules électriques, transformant en profondeur notre vie quotidienne. Elles peuvent aussi favoriser la transition énergétique en ouvrant la voie au stockage des énergies renouvelables (vent, soleil).
Principe de fonctionnement
Dans une pile classique (ou batterie primaire), une cellule comprend deux électrodes reliées par un circuit électrique et séparées par un électrolyte (et fréquemment par un séparateur empêchant leur contact physique, ce qui entraînerait un court-circuit). Pour générer spontanément du courant électrique (décharge), une réaction d’oxydation se produit à l’anode (électrode négative), entraînant les électrons dans le circuit extérieur, tandis qu’une réaction de réduction se produit à la cathode (électrode positive) grâce aux électrons provenant de ce circuit. Dans une batterie rechargeable (ou secondaire), ce processus de décharge peut être inversé avec l’aide d’une source électrique extérieure.
Dans le cas d’un accumulateur lithium-ion, le transport des électrons est accompagné à chaque cycle de la migration d’ions lithium à travers l’électrolyte (de l’anode vers la cathode lors de la décharge et inversement lors de la charge). Ces ions peuvent s’insérer de manière réversible entre les feuillets des matériaux des électrodes, dont les structures demeurent essentiellement inchangées (intercalation). En raison de ce va-et-vient des ions lithium, ces batteries sont parfois appelées rocking-chair.
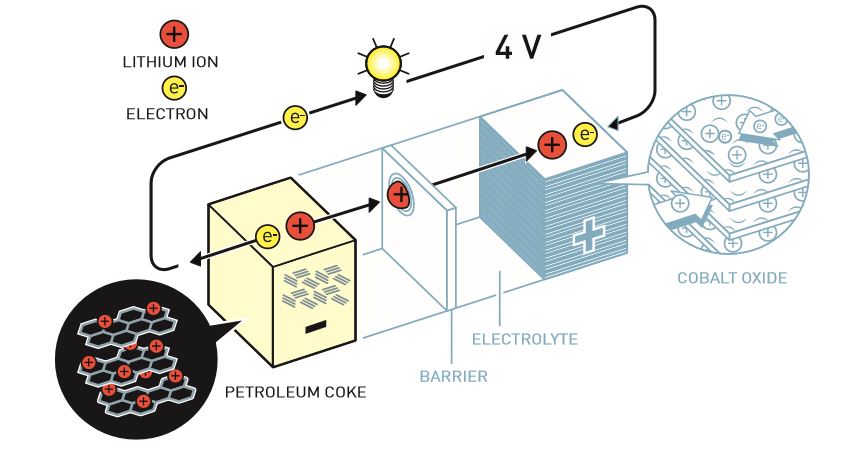
Composition de l’électrolyte
Un électrolyte est un conducteur ionique qui peut se présenter sous une forme liquide, gélifiée, polymérisée, ou solide. Dans la batterie conçue par Whittingham en 1976, l’électrolyte était composé d’un solvant organique, le carbonate de propylène, et d’un sel de lithium, l’hexafluorophosphate de lithium (LiPF6). Certaines recherches ont porté sur des solvants possédant des constantes diélectriques et des viscosités différentes, comme des carbonates linéaires au lieu d’être cycliques, ou d’autres sels, comme le tétrafluoroborate de lithium (LiBF4) ou le perchlorate de lithium (LiClO4), bien que ce dernier soit explosif donc sans visée industrielle.
Une caractéristique importante est la fenêtre de stabilité de l’électrolyte, déterminée approximativement par l’écart énergétique entre sa plus haute orbitale occupée (HO) et sa plus basse orbitale vacante (BV) pour un liquide. En effet, la différence de potentiel entre les deux électrodes ne peut excéder cette fenêtre sous peine de déclencher une réaction d’oxydation ou de réduction de l’électrolyte. Par exemple, la fenêtre de stabilité très réduite d’un électrolyte aqueux limite la tension effective à 1,5 V tandis que celle d’un électrolyte organique est plus large, avec une tension néanmoins inférieure à 5 V.
Électrolyte «Water-in-Salt» (WiSE)
Dans le cadre du développement durable, mais aussi pour des raisons de sécurité, les chercheurs portent leurs efforts depuis 2015 sur l’utilisation d’électrolytes aqueux superconcentrés, malgré la limitation mentionnée précédemment. En effet, il est possible d’élargir la fenêtre de ce type d’électrolyte au-delà de 3 V en augmentant très fortement la concentration du sel de lithium (par exemple LiTFSI) dans l’eau, comme démontré dans un article retentissant publié dans la revue Science.
Au niveau atomique, la prédominance du sel sur l’eau dans les électrolytes superconcentrés entraîne une perte de molécules d’eau et la pénétration de l’anion (par exemple TFSI–) en première sphère de solvatation du lithium. De plus, il n’existe plus de molécules d’eau libres. Par un mécanisme non encore entièrement élucidé à ce jour, la diffusion des ions lithium s’en trouve alors accélérée malgré la plus grande viscosité du milieu (donc en contradiction avec la relation de Stokes–Einstein). Pour expliquer ce paradoxe apparent, il se pourrait que la réorientation rapide des molécules d’eau autour du lithium facilite sa mobilité.

Domaine d’existence de l’eau
Le domaine d’existence de l’eau correspond à la différence entre les potentiels standard apparents de l’eau, qui n’est que de 1,23 V. Hors de cette fenêtre, H2O va s’oxyder en O2 ou se réduire en H2. En solution aqueuse, il ne peut donc théoriquement exister d’oxydant plus fort que O2 ou de réducteur plus fort que H2.


Laisser un commentaire