
Du solide au liquide
Ces dernières années, les solvants eutectiques profonds (en anglais Deep Eutectic Solvents ou DES) font l’objet d’un engouement qui s’explique en partie par l’intérêt croissant porté au développement durable, et qui n’est pas sans rappeler l’effort de recherche sur les électrolytes «Water-in-Salt» (WiSE) dans le domaine des batteries lithium-ion.
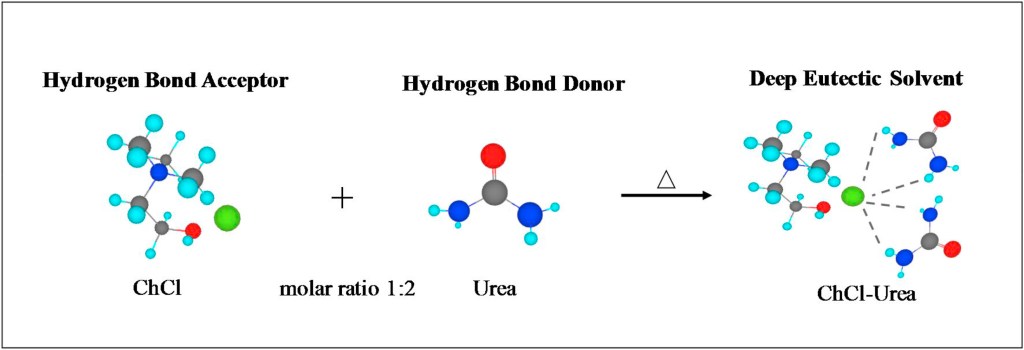
Un mélange homogène est dit eutectique si sa température de fusion/solidification est inférieure aux points de fusion de chacun de ses constituants. Au point eutectique, le mélange peut donc être dans l’état liquide alors que ses constituants purs seraient à l’état solide à la même température. Ce type de solvant est comparable aux liquides ioniques sans que ses constituants soient nécessairement des ions (par exemple des molécules neutres). Par conséquent, les interactions qui gouvernent ces systèmes ne sont pas seulement électrostatiques et comprennent notamment des interactions entre un donneur et un accepteur de liaisons hydrogène (mais aussi des interactions de type van der Waals).
Pour compléter cette description, la présence (fortuite ou délibérée) d’un troisième partenaire peut modifier les propriétés de ce type de solvant : l’eau. Voyons d’abord quelles sont ces propriétés.
Propriétés physicochimiques
La possibilité de sélectionner un solvant eutectique profond (DES) précis pour cibler certaines propriétés présente un avantage important, notamment par comparaison aux solvants organiques plus polluants.
Hormis le changement de phase mentionné précédemment, le DES présente généralement une densité supérieure à celle de l’eau pure, qui diminue quand la température augmente, et une viscosité élevée à température ambiante, qui entraîne une faible conductivité ionique, cette dernière étant aussi diminuée en raison de la grande taille des ions impliqués.
L’addition d’eau permet d’abaisser encore le point de fusion. Dans ces conditions, la viscosité et la conductivité ionique s’en trouvent positivement affectées (notamment dans le cadre d’un électrolyte), avec généralement une diminution de la première et une augmentation de la seconde. Néanmoins, ces bénéfices peuvent être entravés dans le cas d’une dilution trop forte, susceptible d’affaiblir les interactions responsables de l’existence du DES (par exemple par l’hydratation de l’ion chlorure).
Types de DES
Une nomenclature recense quatre types de DES, tous constitués d’un cation, d’une base de Lewis, et d’une base de Brønstedt. Par exemple, les types III et IV sont issus d’un mélange entre un donneur de liaison hydrogène (par ex. l’urée) et d’un sel organique (type III, par ex. le chlorure de choline) ou métallique (type IV, par ex. le perchlorate de lithium).


Laisser un commentaire