- Vision du chimiste
- Théorie des Atomes dans les Molécules
- Fonction de Localisation Electronique (ELF)
- Quid des interactions non covalentes ?

Vision du chimiste
Le point de vue du chimiste suppose d’abord une localisation des électrons vus comme des corpuscules classiques qui est en désaccord avec la mécanique quantique. Pourtant, grâce à l’approche que Lewis a proposée en 1916, qui fait l’hypothèse d’une mise en commun d’une paire d’électrons localisée entre deux noyaux, et la méthode VSEPR de Gillespie permettant d’établir une structure tridimensionnelle basée sur la répulsion électrostatique, le chimiste peut imaginer et construire des édifices moléculaires avec une certaine efficacité.
Théorie des Atomes dans les Molécules
Pour concilier le point de vue du chimiste et la mécanique quantique, Richard Bader (1931-2012) propose une analyse topologique de la densité électronique, qui est une grandeur observable dans le formalisme quantique. Cette technique mathématique revient finalement à tracer les trajectoires du gradient de la densité électronique. La liaison chimique apparaît alors sous la forme d’un chemin (bonding pathway) qui relie deux bassins atomiques. Cette méthode fournit donc une définition rigoureuse de la liaison chimique mais se heurte néanmoins à des limitations qui seront dépassées grâce au choix d’une autre fonction que la densité électronique.

Fonction de Localisation Electronique (ELF)
Dans les années 1990, Becke et Edgecombe propose une fonction définie non pas à partir de la densité électronique mais de la densité de paire.
où
qui fait intervenir les spinorbitales, et
où CF est la constante de Fermi, et D0 représente l’énergie cinétique d’un gaz homogène d’électrons. De cette manière, la fonction ELF varie entre 0 (absence de localisation) et 1 (forte localisation). Une liaison covalente, avec mise en commun d’électrons, est alors caractérisée par la présence d’une bassin de liaison, au contraire d’une liaison ionique par exemple.
Mentionnons aussi qu’il est possible d’appliquer l’analyse de la fonction ELF à des liaisons sans mise en commun d’électrons, telles que la liaison hydrogène ou l’interaction de Van der Waals.
Quid des interactions non covalentes ?
La détection d’interactions non covalentes (liaison hydrogène, interactions dipolaires, dispersion) pose aussi des problèmes sur le plan théorique. Plusieurs solutions ont été proposées dont celle de Johnson et al en 2010 : la méthode NCI. Celle-ci s’appuie sur le gradient de la densité réduit,
Les auteurs auraient découvert une signature des interactions non covalentes : une chute du gradient réduit pour des faibles densités électroniques. Ceci permettrait d’isoler dans l’espace les régions où règnent des interactions non covalentes. Pour mieux distinguer le type de ces interactions faibles, le laplacien de la densité serait alors nécessaire.
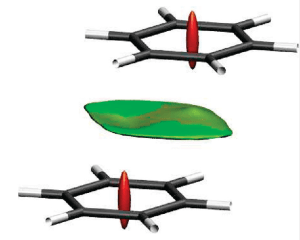
Comme dans d’autres approches topologiques, la tentative de représenter la liaison chimique de façon rigoureuse n’est pas seulement d’ordre qualitatif mais aussi quantitatif (par exemple en calculant des intégrales dans des régions de l’espace bien délimitées). Mais des difficultés subsistent, dont l’origine se trouve immanquablement dans la nature même de la mécanique quantique.


Laisser un commentaire